Inauguré en février, le Centre de génomique médicale offre une lueur d’espoir pour les patients en errance diagnostique ou dont les traitements ne sont pas efficaces.
Mardi 15 janvier, 10h, visioconférence, bâtiment Gustave Julliard. Les stores s’abaissent en silence derrière l’immense baie vitrée et plongent la salle dans une douce pénombre. Le projecteur s’allume. Un dossier médical s’affiche sur l’écran grand comme une toile de cinéma. Les visages de la quinzaine d’experts réunis autour de la table en V se nimbent de lumière bleue. «Voilà. Commençons!», s’exclame le Pr Marc Abramowicz, médecin-chef du Service de médecine génétique. Le premier genome board des HUG vient de démarrer.
Un genome… quoi? En fait, il s’agit d’un colloque interdisciplinaire où généticiens et spécialistes cliniques unissent leurs compétences pour débusquer le gène responsable d’une maladie, souvent rare. En cas de succès, le patient suivra un traitement adéquat ou, au minimum, mettra un nom sur sa pathologie, après des années d’errance médicale.
Pour comprendre la portée novatrice de cette séance inaugurale et mesurer le chemin parcouru, un retour dans le temps s’impose. Pas de beaucoup. Une vingtaine d’années. Souvenez-vous, au tournant du millénaire, après dix ans de travaux, l’ADN humain est décrypté de A à Z pour la première fois. Un nouveau continent biologique est cartographié.
Avancée fulgurante
Le hic au départ? Le coût: près d’un milliard de dollars. Mais l’histoire ne s’arrête pas là. Les progrès sont rapides. Dix ans plus tard, arrive le séquençage à haut débit. Si bien qu’aujourd’hui, la lecture complète d’un ADN prend trois semaines et coûte environ quatre mille francs. La progression est vertigineuse. Un peu comme si vingt ans après l’alunissage d’Apollo 11, des charters mettaient à portée de toutes les bourses un week-end romantique sur la Lune.
Ce développement fulgurant a posé les bases d’une véritable révolution médicale. Au fil des ans, par recoupement et analyse des bases de données biomédicales, les chercheurs découvrent les liens entre des mutations génétiques et des maladies. «À ce jour, des mutations dans quelque 4’000 gènes sont reliées à plus de 7’000 maladies. Et on trouve chaque année 200 nouveaux gènes dont l’altération est la cause d’une pathologie», se réjouit le Pr Abramowicz.
Un cas sur trois résolu
Pour que les personnes atteintes d’une maladie génétique bénéficient de ces nouvelles connaissances, les HUG ont inauguré en février 2019 le Centre de génomique médicale (CGEM). «Pour l’instant, sont traitées uniquement les affections monogéniques. C’est-à-dire celles causées par un seul gène défectueux. Elles concernent environ 5% des patients. Parmi ces derniers, certains n’ont pas le bon diagnostic et donc pas les bons traitements. D’autres, pas de diagnostic du tout. Les genome boards pilotes menés en 2018 ont résolu un tiers des cas examinés», poursuit le généticien.
Alors que les médias bruissent des annonces de laboratoires privés – outre Atlantique ou plus près de chez nous – promettant le Graal sur la base d’un simple frottis buccal, pourquoi créer un centre? Le Pr Abramowicz met en garde contre les miroirs aux alouettes: «La génomique est une science nouvelle et complexe. Les résultats d’une analyse de l’ADN contiennent encore beaucoup d’erreurs, d’inconnues et d’incertitudes. Pour en tirer autre chose que quelques vagues probabilités, il est indispensable de travailler avec les médecins.»
Et c’est là qu’interviennent les genome boards. Organisés dans le cadre du CGEM, ils ont lieu tous les mardis avec, à tour de rôle, quatre spécialités: la pathologie hépatobiliaire, l’oto-rhino-laryngologie, le neuro-développement et la cardiologie. À terme, le Pr Abramowicz souhaite les étendre à toutes les spécialités des HUG et les ouvrir aux praticiens de ville. Concrètement, ces colloques interdisciplinaires réunissent des spécialistes cliniques, pathologistes, radiologues, biologistes, bio-informaticiens et, bien entendu, généticiens autour d’une dizaine de cas difficiles ou non résolus. Soit environ 400 cas par année. «Nous n’examinons pas tout le génome, mais un panel de gènes de l’exome. En moyenne, plusieurs centaines de gènes. Après un premier tri, il reste une dizaine de candidats, qui seront présentés aux genome boards. La discussion avec les experts cliniques est indispensable pour trouver le coupable. Comme dans une enquête de police, on confronte les indices – le tableau clinique du patient – avec les profils des suspects, soit les gènes incriminés», illustre Eva Hammar Bouveret, biologiste et coordinatrice du CGEM.
Vers une médecine prédictive
Les genome boards sont au cœur de l’activité du CGEM. «Avec ce centre, nous faisons autrement et ouvrons à tout l’hôpital des prestations que la médecine génétique proposait déjà dans certaines disciplines de pointe (Consulter La génétique au service des cancers et Trouver les causes de la déficience intellectuelle). L’objectif est aussi de nous préparer aux importantes évolutions à venir en médecine prédictive et personnalisée», souligne le Pr Abramowicz. La première concerne essentiellement les maladies polygéniques, causées par des mutations dans plusieurs gènes. Comme l’infarctus, le diabète ou encore la sclérose en plaques. Dès lors, cela concerne 30% des patients touchés et non plus 5%. La seconde prévoit d’affiner les diagnostics classiques en fonction des caractéristiques génétiques de la pathologie.
Pour répondre à ces défis, le CGEM prépare la prochaine grande étape: le séquençage complet du génome au lieu des panels actuels. «Le CGEM constitue un investissement au départ. Mais à l’arrivée, si on évite une errance médicale à de nombreux patients et qu’ils reçoivent plus vite les bons traitements, on peut économiser jusqu’à 90 % des coûts de la santé», conclut le Pr Abramowicz.
Glossaire
GÉNOME : totalité de l’information génétique d’un individu. Une moitié est transmise par la mère. L’autre, par le père.
ADN : matériel sur lequel le génome est écrit.
GÈNE : unité de base du génome. En clinique, seuls les gènes qui codent des protéines sont examinés.
GÈNE RÉCESSIF : gène qui ne s’exprime que s’il est contenu à double dans le génome. Autrement dit, si le gène transmis par la mère et le père sont identiques
EXOME : La partie du génome qui code pour les protéines. Elle ne représente que 1,3% du génome.
SÉQUENÇAGE À HAUT DÉBIT : Méthode décryptant simultanément des milliers de fragments d’ADN. Le séquençage à haut débit est infiniment plus rapide que la technique classique (méthode de Sanger). Utilisé dans la recherche depuis 2000, son application clinique et diagnostique a démarré il y a moins de dix ans.
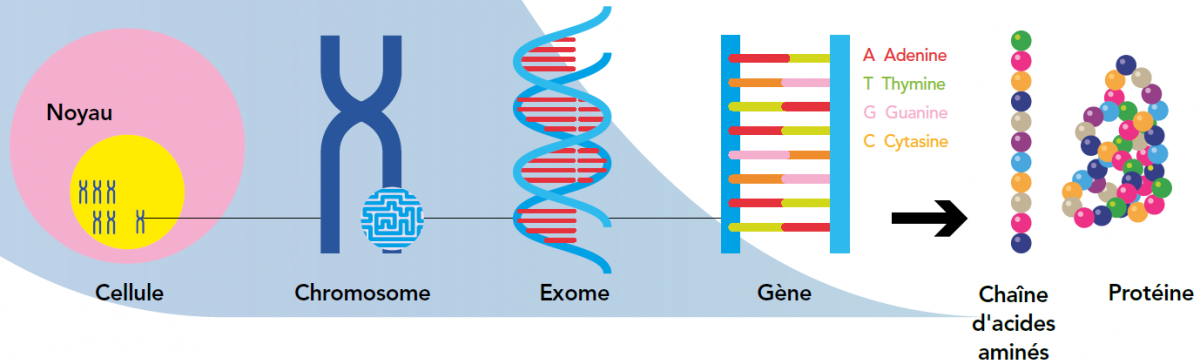
Du gène à la protéine
D’un point de vue clinique, seule la partie du génome appelée exome est intéressante. Car elle contient les gènes utilisés pour fabriquer des protéines. Comment? Les protéines sont des longues chaînes d’acides aminés, un genre de molécule dont il existe environ 500 variétés différentes. L’organisme en utilise vingt. Il les désigne chacun par un nom propre composé avec les lettres de l’ADN: A, T, C et G. Un gène n’est en fait rien d’autre qu’une liste de ces noms, énumérés comme sur une liste de commissions. Lorsqu’une cellule en reçoit une copie, elle l’utilise pour assembler les acides aminés dans le bon ordre, un par un. Une fois constituée, la chaîne se replie et forme une protéine, soit un objet tridimensionnel possédant certaines propriétés physicochimiques. Comme par exemple celle de pouvoir transporter du glucose jusqu’au cerveau (c’est la protéine GLUT-1).
L’ADN est recopié des milliards de fois. Ce processus n’est pas à l'abri d’erreurs: des noms peuvent être effacés, intervertis, mal «orthographiés», etc. Lorsque cela arrive des acides aminés manquent ou ne sont pas à leur place. Dans ce cas, la chaîne se replie mal, les propriétés de la protéine sont perdues ou déficientes et cela cause une maladie. On parle alors de mutation génétique. Par exemple, si GLUT-1 est mal conformée, le cerveau ne reçoit pas de glucose et la personne souffre d’une forme rare d’épilepsie.

Le genome board est un colloque interdisciplinaire où généticiens et spécialistes cliniques unissent leurs compétences pour débusquer le gène responsable d’une maladie, souvent rare.
Dossier génomique
- La révolution génomique au coeur des soins
- La génétique au service des cancers
- Trouver les causes de la déficience intellectuelle
- Maladies rares : prise en charge en réseau
- Expliquer simplement la complexité
Texte:
- André Koller
Photos:
- Bogsch & Bacco - Julien Gregorio










